Eficiencia y coste de oportunidad de la asociación de naproxeno y esomeprazol. La necesaria revisión del procedimiento de financiación de medicamentos
Maldonado-Alconada J1, Palenzuela-Paniagua SMª2, Domínguez-Vera A3, García de Paredes-Esteban JC4, Maldonado-Centeno AM5
1Especialista en MFyC. Centro de Salud Tarajal, Ceuta. Unidad Docente de Medicina Familiar y Comunitaria de Ceuta
2Especialista en MFyC. Centro de Salud Otero, Ceuta
3MIR de MFyC. Centro de Salud Tarajal, Ceuta. Unidad Docente de Medicina Familiar y Comunitaria de Ceuta
4Especialista en farmacia hospitalaria, Unidad de Farmacia. Dirección de Atención Primaria de Ceuta
5MIR de MFyC. Centro de Salud Almanjáyar. Unidad Docente de Medicina Familiar y Comunitaria Distrito Granada Metropolitano
Título: eficiencia y coste de oportunidad de la asociación de naproxeno y esomeprazol. La necesaria revisión del procedimiento de financiación de medicamentos.
Objetivos: identificar los patrones de prescripción y consumo de naproxeno 500 mgr y esomeprazol 20 mgr (NE500/20), evaluar el impacto económico y la eficiencia de su uso.
Diseño: estudio descriptivo transversal.
Emplazamiento: área sanitaria de Ceuta.
Población y muestra: en el programa de gestión de recetas Digitalis, se identificaron los envases retirados con prescripción y financiación del SPS, y variables asociadas.
Intervenciones: se analizaron el consumo por paciente, los patrones de prescripción y uso, y el coste. Se comparó el gasto real en NE500/20 con el potencial de haber usado equivalentes terapéuticos (naproxeno/omeprazol o etoricoxib). Se analizó el proceso de inclusión de NE500/20 en la financiación pública.
Resultados: se prescribieron 12.450 envases a 5.467 personas, de las cuales el 68% retiró solo un envase. El 7% retiró 6 envases o más en el periodo de estudio. NE500/20 resultó la pauta más cara, con un exceso de coste de 206.159 € (182%) respecto a la pauta más eficiente de equivalentes terapéuticos. El 22% de los cupos concentraron la mitad de los tratamientos prolongados.
Conclusiones: el consumo de NE500/20 fue mayoritariamente puntual, y solo una minoría de pacientes lo tomó de manera prolongada. Existieron importantes diferencias en los patrones de prescripción. NE500/20 se asoció a un importante sobrecoste respecto a alternativas más eficientes. Los procedimientos de autorización, financiación y seguimiento de los medicamentos deben considerar los aspectos económicos y sociales.
Palabras clave: esomeprazol, naproxeno, costo de oportunidad, análisis de costo-minimización, macrodatos.
Title: Efficiency and opportunity cost of the combination of naproxen and esomeprazole. The necessary revision of the procedure for financing medicines.
Aims: To identify prescription and consumption patterns of the combination of naproxen 500 mgr and esomeprazole 20 mgr (NE500/20), and to evaluate the economic impact and efficiency of the use of the fixed dose.
Design: A descriptive cross-sectional study.
Location: Health Area of Ceuta.
Population and sample: Prescription medicine packages dispensed and financed by the public health service were identified in the Digitalis prescription medicine monitoring program, together with other associated variables.
Interventions: Analyses were conducted on the consumption per patient, patterns of prescription and use, and costs. The actual cost of NE500/20 was compared with the potential cost of therapeutic equivalents (naproxen/omeprazole or etoricoxib). The process to include NE500/20 for public funding was evaluated.
Results: A total of 12,450 package units were prescribed to 5,467 people, of whom 68% picked up only one unit. Only 7% picked up at least six package units over the study period. NE500/20 proved to be the most expensive regimen, with an overrun cost of 206,159 € (182%) compared to the most efficient regimen of therapeutic equivalents. 22% of the medical practices accounted for half of the long-term treatments.
Conclusions: NE500/20 was consumed mainly occasionally, and only a small proportion of patients used it in the long term. Significant differences were observed among prescribing patterns. NE500/20 was associated with an important overrun cost compared to more efficient alternatives. Procedures for the authorization, financing and monitoring of medications should take into account the economic and social aspects.
Keywords: Esomeprazole, naproxen, opportunity cost, cost minimisation analysis, Big Data.
INTRODUCCIÓN
La Ley de garantías y uso racional de los medicamentos (1) (Ley del medicamento) establece que para obtener la autorización y financiación pública de un medicamento se deben acreditar su calidad, seguridad y eficacia ante el Ministerio de Sanidad.
Promueve también una financiación selectiva que tenga en cuenta el coste-efectividad y el impacto presupuestario en el Sistema Nacional de Salud, el valor terapéutico y social del medicamento y la existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a inferior coste de tratamiento.
En 2011 se acordó en España la financiación por la sanidad pública de la asociación de naproxeno y esomeprazol, en una única presentación de 500 y 20 miligramos (mgr) respectivamente (NE 500/20), con una posología de un comprimido cada 12 horas e indicación para el tratamiento de los síntomas de la artrosis, artritis, artritis reumatoide y espondilitis anquilosante, en pacientes con riesgo de desarrollar úlceras gástricas o duodenales asociadas a antiinflamatorios no esteroideos (AINE) (2).
La asociación a un antiinflamatorio en dosis fija y presentación única de un inhibidor de la bomba de protones considerado de segunda elección y coste elevado ha despertado dudas sobre su eficiencia desde el inicio de la comercialización (3,4). Además, la observación informal de su uso clínico sugiere la existencia de patrones de prescripción no ajustados a sus indicaciones aprobadas.
Para verificar o descartar estas hipótesis, se realizó un estudio con los siguientes objetivos:
- a) Identificar los patrones de prescripción y consumo de este medicamento
- b) Evaluar el impacto económico y la eficiencia de su uso.
MATERIAL Y MÉTODOS
Se diseñó un estudio descriptivo transversal, que se llevó a cabo en el área sanitaria de Ceuta, dependiente del Instituto Nacional de Gestión Sanitaria, que atiende a una población de 76.980 personas. El área dispone de 3 centros de salud, con 37 consultas de medicina de familia y comunitaria y 12 de pediatría, un servicio de urgencias de atención primaria y un hospital.
A partir del programa de facturación de receta médica Digitalis, y para el período comprendido entre el 1 de enero de 2015 hasta el 31 de diciembre de 2019, se identificaron todos los envases retirados con prescripción y financiación del Sistema Público de Salud (SPS) del medicamento con código nacional 676735 (correspondiente a la combinación de naproxeno 500 mgr y esomeprazol 20 mgr (NE500/20) en envase de 60 comprimidos). Se obtuvieron las siguientes variables: código de identificación personal (CIP), código identificativo de asistencia sanitaria del médico (CIAS), edad en el momento de la prescripción, sexo, centro de salud del paciente y médico de familia, régimen de aportación, coste financiado por el SNS y coste aportado por el usuario. Una vez anonimizados a nivel de paciente y prescriptor, los datos fueron analizados usando el programa Microsoft Access ®.
Se analizaron los patrones de consumo por paciente y prescripción por médico para identificar los patrones de uso. Se fijo arbitrariamente en 6 envases, correspondientes a 6 meses de tratamiento, el uso mínimo esperable del medicamento al ser todas sus indicaciones patologías crónicas.
Se comparó el gasto real en NE 500/20 con el potencial de haber usado equivalentes terapéuticos. La elección de los equivalentes terapéuticos se realizó de acuerdo con las recomendaciones de varias sociedades científicas, seleccionando el naproxeno 500mgr, mismo AINE no selectivo que el fármaco a estudiar, y un inhibidor selectivo de la ciclooxigenasa 2 en dosis de 60mgr y 90mgr (5). El esomeprazol, por su parte, fue comparado con la dosis recomendada en la indicación de prevención de lesiones digestivas por AINE (20 mgr diarios) (6) y con el omeprazol 20 mgr, recomendado como fármaco de elección para la gastroprotección cuando esta se considera necesaria (7).
La comparación se hizo en base al número de días de tratamiento correspondientes a las prescripciones de NE500/20 a la dosis recomendada.
Los importes se han redondeado al euro y los porcentajes a la unidad.
RESULTADOS
1.- Patrón de prescripción:
1.1.- Perfil de pacientes y consumo
En los 5 años analizados se dispensaron con receta del SPS 12.474 envases de NE 500/20, de los se incluyeron 12.450 que tenían datos válidos. Se prescribieron a 5.467 personas, el 65% mujeres, con una edad media de 52,8 años (rango de 10 a 100 años). El coste total ascendió a 319.094 €, de los cuales 259.826 € (81%), fueron abonados por el SPS y 59.267 € (19 %) por las aportaciones de los pacientes.
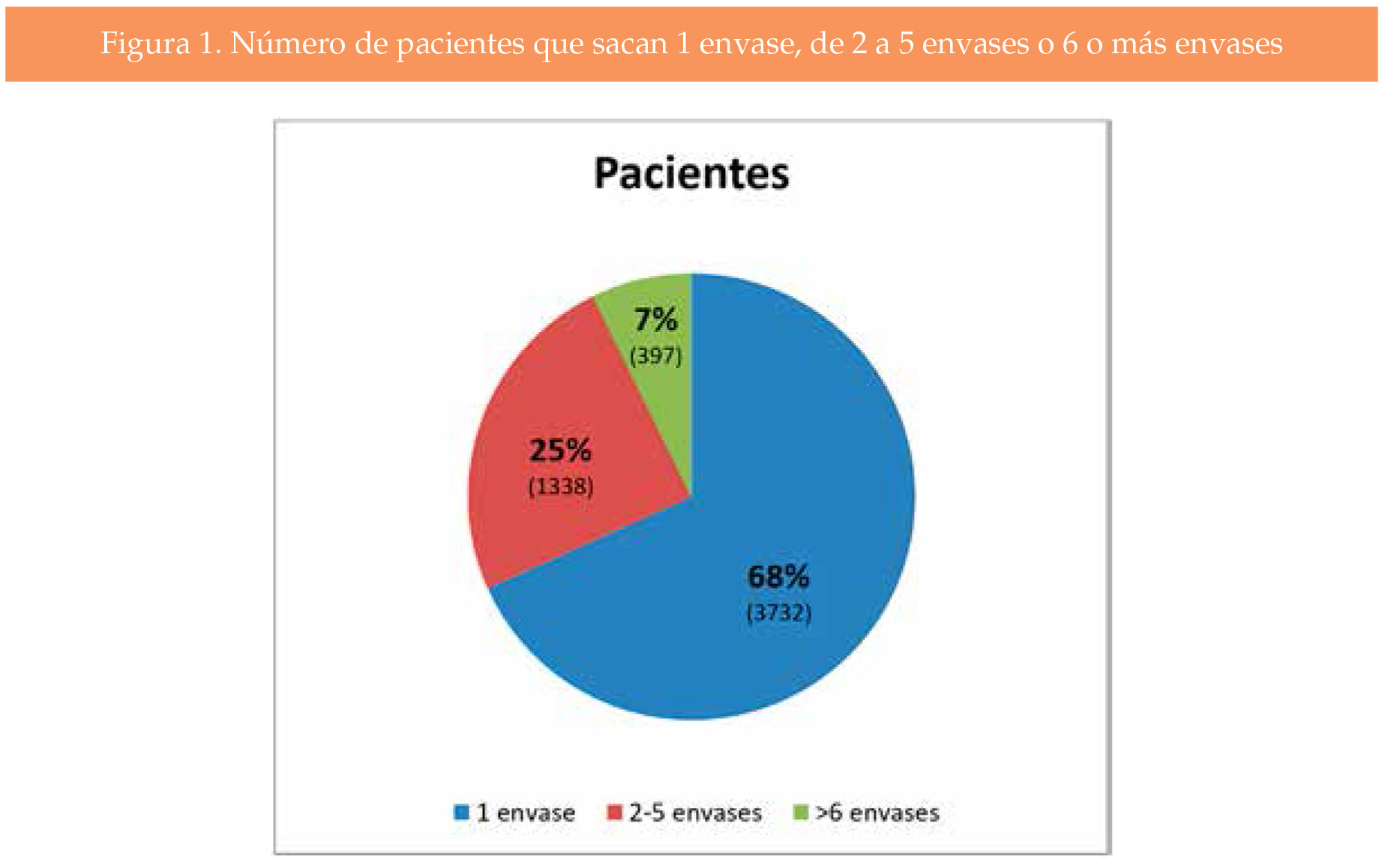
La media de envases prescritos por persona fue de 2,28 (rango de 1 a 59). El 68 % de las personas (3732) retiró un solo envase. Estas prescripciones únicas supusieron el 30 % de los envases totales, con un coste de 95.651 €. La edad media de este grupo fue de 50.7 años (Figura 1).
El 93 % de las personas (5070) retiraron 5 envases o menos en los 5 años, suponiendo este grupo el 59 % de los envases, con un coste de 187.150 €. Su edad media fue 52,17 años.
Un total de 397 personas (7 % de las que recibieron NE 500/20) retiraron 6 envases o más de este medicamento en los 5 años (media de envases 7,35 envases por persona en 5 años), y su edad media fue de 61,0 años (Figura 1).
El porcentaje de pacientes con aportación reducida (del 0 al 30% del precio del envase) fue de 81% para los que retiraron 6 envases o más, y del 50% para los que retiraron 5 envases o menos.
1.2.- Perfil de prescripción por cupo
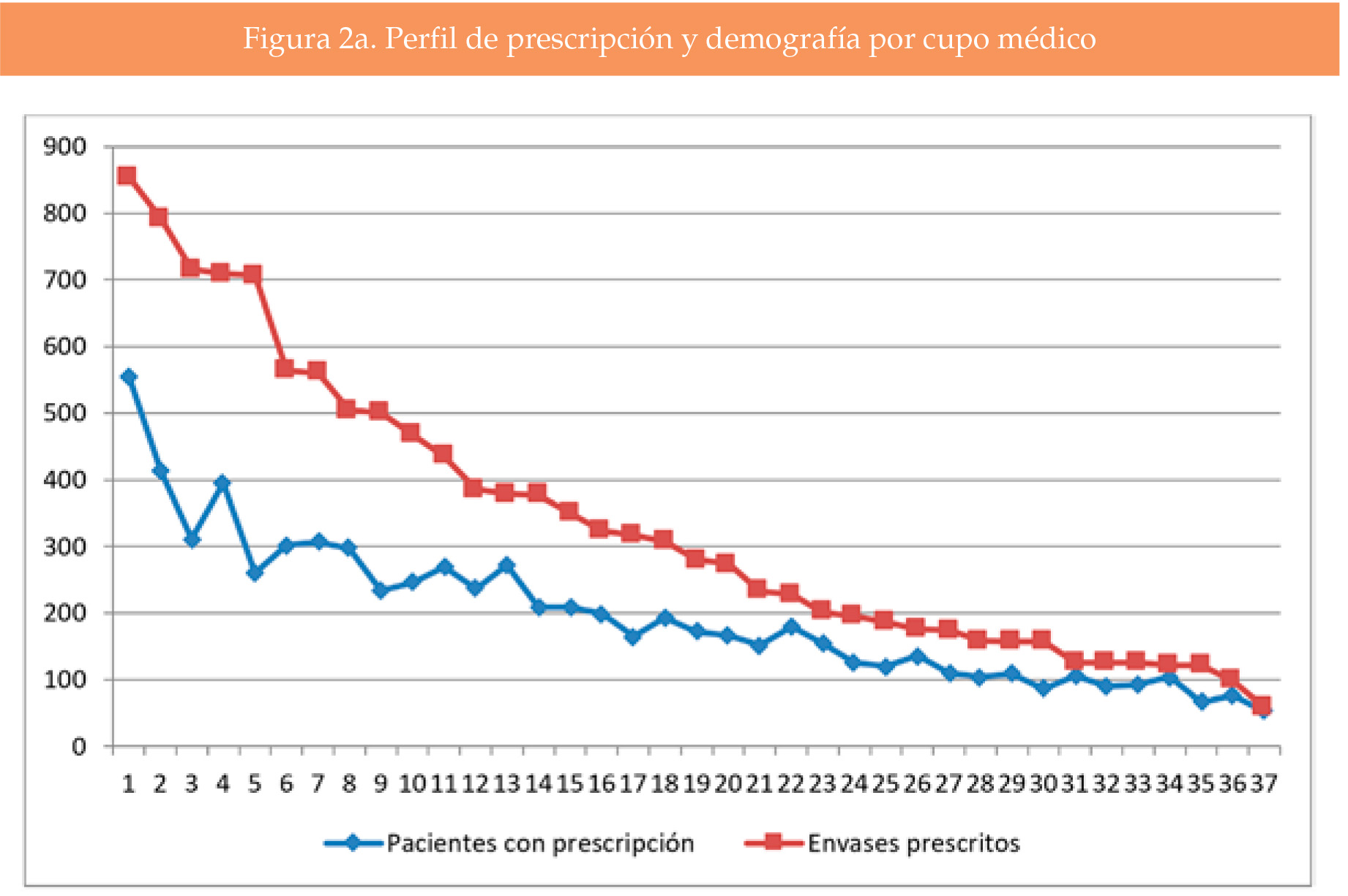
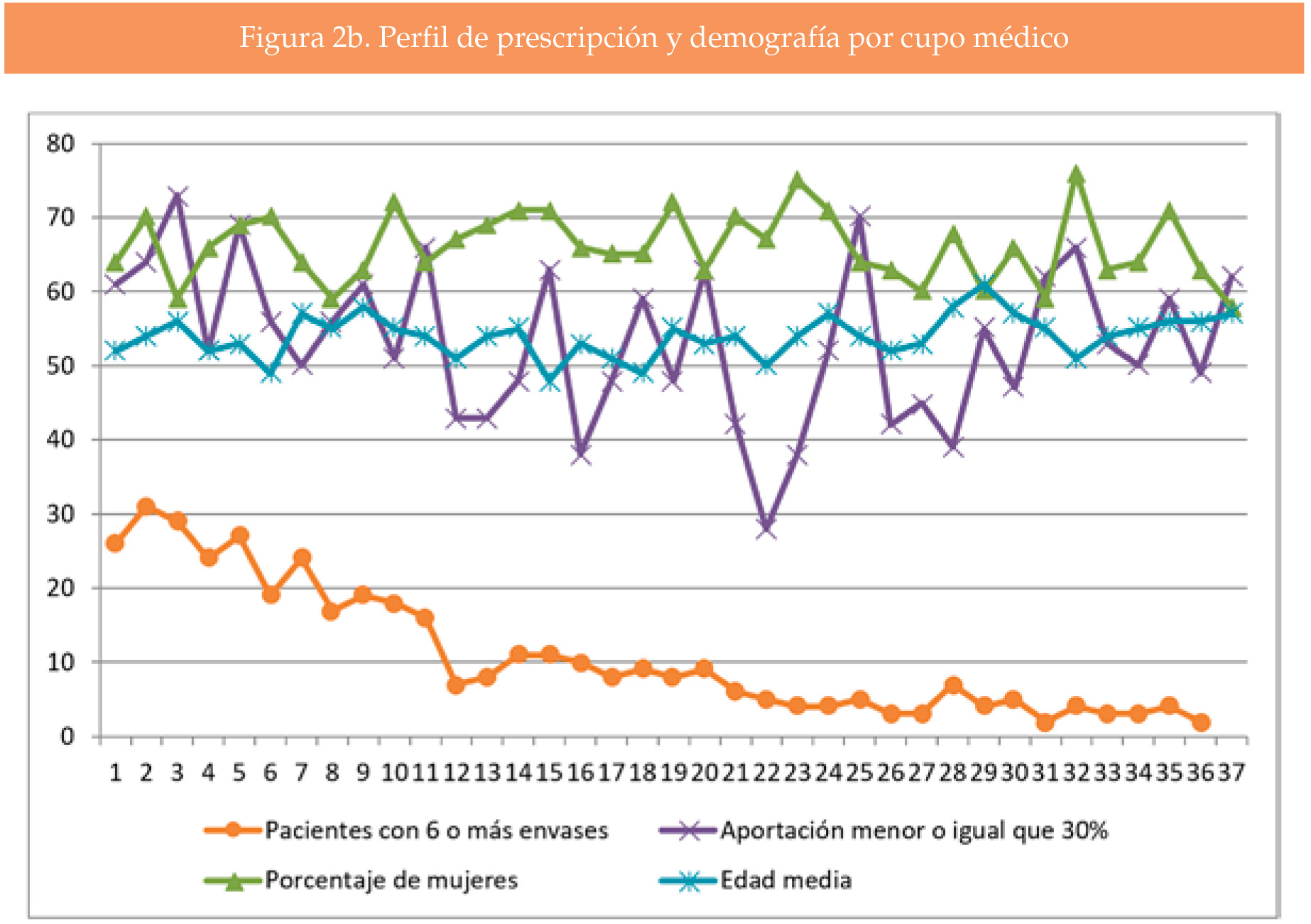
El número de personas con prescripción de NE 500/20 por cupo osciló entre 49 y 410 (mediana 154, 193 en el percentil 75, 227 en el percentil 90). El número de personas con 6 o más envases prescritos en los 5 años osciló entre 0 y 31 por cupo (mediana 8, 18 en el percentil 75, 26 en el percentil 90). De los 37 cupos, 8 de ellos (22%) sumaban el 50% de los pacientes con 6 envases o más.
El coeficiente de correlación de Spearman para los cupos médicos entre el número de personas con alguna prescripción y el número de personas con 6 o más prescripciones, fue significativo con valor de 0.99751. No se encontró para la edad, el sexo y el porcentaje de aportación (Figura 2a y 2b).
2.- Estudio de costes
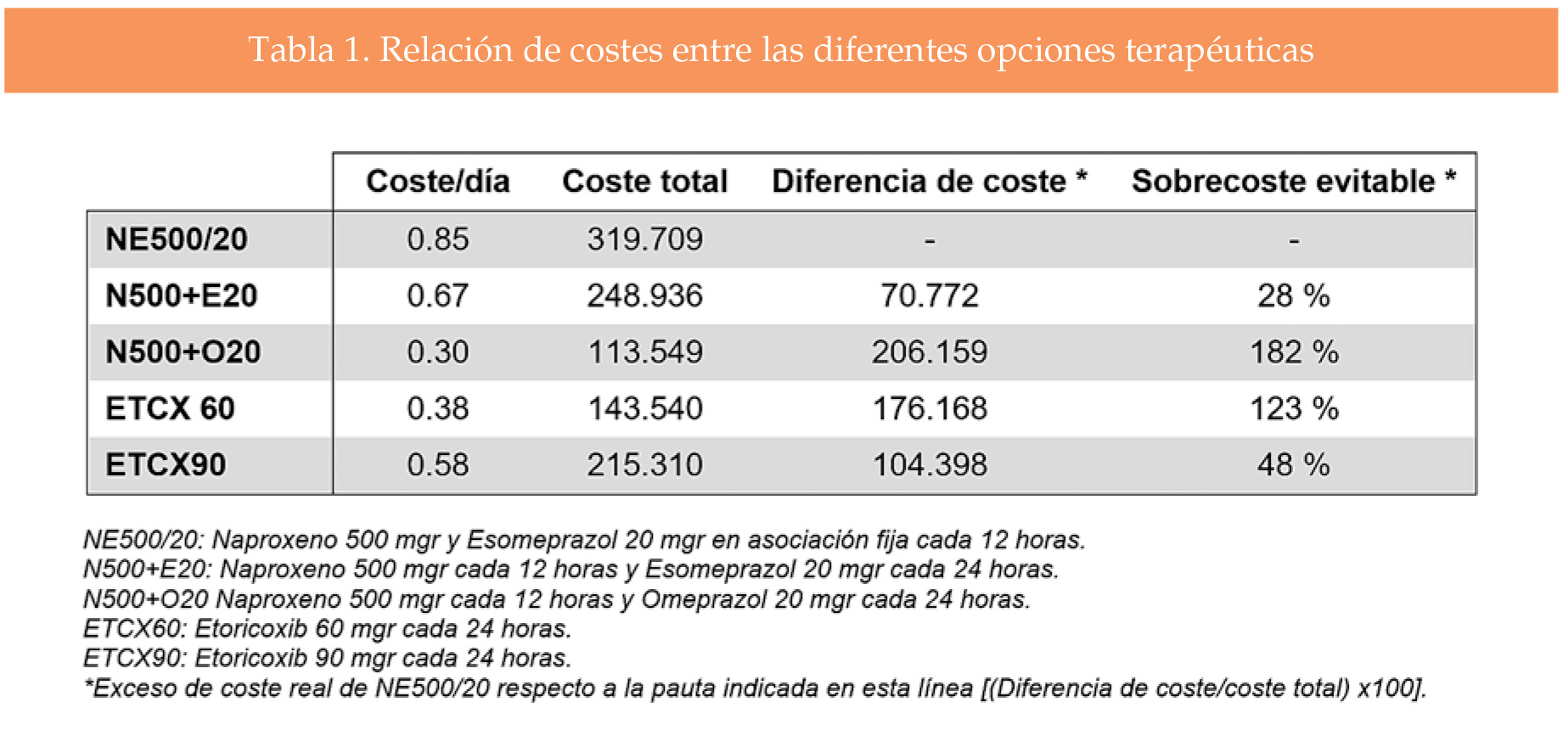
En la comparación de costes (tabla 1), la pauta NE 500/20, definida como un comprimido cada 12 horas, resultó la más cara. La de menor coste fue la asociación de naproxeno 500 mgr un comprimido cada 12 horas con una dosis al día de omeprazol 20 mgr, con un sobrecoste evitable del 182% (206.159 €).
El uso por separado de esomeprazol a la dosis de 20 mgr hubiese supuesto un sobrecoste evitable del 28% (70.772 €). El uso de etoricoxib a dosis de 60 o 90 mgr al día hubiese supuesto un sobrecoste evitable del 123% (176.168 €) o del 48% (104.398 €), respectivamente.
DISCUSIÓN
El presente trabajo se basa en un estudio descriptivo transversal que analiza el perfil de prescripción y consumo de 37 consultas de Atención Primaria correspondientes a un período de 5 años en un área sanitaria concreta, a partir de los datos recogidos del programa de facturación de receta médica Digitalis. Los resultados no tienen por qué ser extrapolables a otros períodos o áreas.
El uso de una base de datos poblacional, impidió recoger la indicación clínica individual de cada envase (no codificada de manera sistemática en ninguna base de datos disponible), pero permitió recoger de forma fiable la práctica totalidad de los envases prescritos y el resto de variables incluidas en este trabajo. Esto, junto a la extensión en el tiempo, el número de datos recogidos y la magnitud de las diferencias encontradas apoyan su relevancia.
En relación al primer objetivo, la identificación de los patrones de prescripción y consumo, objetivamos que, en los 5 años, solo el 7% de las personas a las que se prescribió NE 500/20 retiró los envases correspondientes a, al menos, 6 meses de tratamiento. Además, en el análisis de la densidad de incidencia de la prescripción, el elevado porcentaje de pacientes solo retiró un envase en 5 años (68%), lo que contrasta con su indicación exclusiva para patologías crónicas.
El carácter agregado de los datos impide conocer con seguridad las causas, pero entre ellas, se podrían apuntar las siguientes hipótesis:
- a) Prescripción para patologías agudas:
1.- Prescripción puntual en urgencias, que es asumida por el médico de familia asignado al paciente para emitir la receta médica. Ello explicaría que en todas las consultas se hayan hecho prescripciones.
2.- Prescripción por propia iniciativa del médico: Ello explicaría la diferencia entre los facultativos en el número de prescripciones.
- b) Prescripción para patologías crónicas que no se mantiene en el tiempo:
1.- Prescripción iniciada en Atención Especializada que el médico de familia sustituye por uno de sus equivalentes terapéuticos. La elevada correlación entre prescripciones totales y prescripción repetida señala la importancia de las diferencias de práctica.
2.- Prescripción iniciada en Atención Especializada o Atención Primaria que se sustituye por desistimiento de la paciente. Entre estas causas podríamos apuntar el abandono por no percibir diferencia frente a otras alternativas, especialmente si se realiza copago. Este último aspecto concordaría con la diferente proporción de envases retirados entre pacientes con un copago mayor y menor al 30%.
Sería interesante en futuras líneas de investigación estudiar la adecuación de cada prescripción a las indicaciones autorizadas, aunque esto resulta actualmente complicado por la dificultad de garantizar su fiabilidad y porque se debería recoger la indicación por envase, y no por paciente, ya que un paciente puede tener varias indicaciones.
En relación a los patrones de prescripción, existen diferencias entre los distintos cupos de médicos. Una minoría de cupos concentra el grueso de las prescripciones, futuros estudios podrían investigar los factores asociados al perfil prescriptor.
En relación al segundo objetivo, evaluar el impacto económico y la eficiencia de su uso, los criterios de comparación han intentado minimizar los sesgos. Las diferencias de coste son muy significativas y, asumiendo excepciones puntuales, poco justificables en conjunto desde un punto de vista clínico. Es importante notar que la comparación económica correcta no es el ahorro potencial respecto al gasto realizado, sino el sobrecoste innecesario debido a no haber usado el tratamiento recomendado (naproxeno 500 mgr y omeprazol 20 mgr). Respecto a este, el exceso de gasto fue del 182%.
El sobrecoste absoluto, 206.159€, podría haber alcanzado cifras aún mayores de haberse recetado y mantenido el medicamento estudiado a un mayor número de pacientes. Las diferencias en los patrones de prescripción entre consultas de Medicina de Familia (otro de los objetivos de este estudio) sugieren que la mayor parte de los médicos apenas mantuvieron tratamientos, conteniendo así el gasto de forma importante.
Las diferencias en la proporción de pacientes con un régimen de aportación económica menor del 30% respecto a las que aportaban un porcentaje mayor, podría indicar que los pacientes con mayor aportación mostraron menor adherencia al fármaco. Resulta, por tanto, plausible considerar que el precio pudo disuadir a quienes tenían que realizar un copago significativo sin percibir diferencias relevantes en beneficio clínico, aspecto que también podría estudiarse en el futuro.
Los hallazgos de este estudio, fueron en gran medida anticipados por los informes de evaluación del medicamento de diferentes servicios de salud autonómicos al inicio de la comercialización, en base a consideraciones habituales: la asociación fija, en una sola presentación, de un medicamento de primera elección a dosis de inicio, con un medicamento de segunda elección, de precio elevado, y a una dosis superior a la recomendada (3,4).
¿Por qué, entonces, se informó favorablemente (8) y se aprobó la comercialización y financiación de este medicamento por el SNS español? NE 500/20 fue autorizado en base a la evaluación realizada por la Medicines Evaluation Board in the Netherlands (9), de acuerdo con la Directiva 2001/83/CE del Parlamento Europeo y del Consejo (10) que extiende a toda Europa los efectos de una evaluación positiva en un Estado miembro. Esta evaluación fue exhaustiva en relación a los aspectos clínicos y farmacológicos, pero no incluyó ningún aspecto socio-económico. Sí hizo referencia, en el apartado “Risk Management Plan” a la posibilidad de un uso fuera de indicación que no respetase su carácter de tratamiento de segunda línea. En este sentido, recomendaba un seguimiento postcomercialización, que no consta que se haya realizado en España.
Su inclusión en la financiación pública española se acordó en un procedimiento regulado en el artículo 92 de la Ley del Medicamento, que establece una financiación selectiva y no indiscriminada teniendo en cuenta criterios generales, objetivos y publicados, entre los cuales están el valor terapéutico y social del medicamento y el beneficio clínico incremental del mismo teniendo en cuenta su relación coste-efectividad, la racionalización del gasto público destinado a prestación farmacéutica, el impacto presupuestario en el SNS y la existencia de medicamentos u otras alternativas terapéuticas para las mismas afecciones a menor precio o inferior coste de tratamiento. Su precio se acordó según lo establecido en el artículo 94, que establece que la Comisión Interministerial de Precios de los Medicamentos tendrá en consideración los análisis coste-efectividad y de impacto presupuestario.
El hecho de que durante el procedimiento de inclusión en la financiación y fijación de precio no se detectase la previsible ineficiencia del medicamento, que sí previeron los Servicios de Farmacia, puede atribuirse, en parte, a la fragmentación del proceso en evaluaciones parciales secuenciales que cumplen cada una su propia lógica interna (la farmacológica, la de seguridad, la de eficacia, la de coste de los componentes), pero que carecen de una valoración integradora que las considere conjuntamente. Es cierto que la Ley del Medicamento considera los aspectos económicos y sociales, pero estos conceptos aparecen separados y en un segundo plano frente a los aspectos farmacológicos y clínicos que centran el proceso de autorización. La inclusión en el proceso de médicos de familia y farmacéuticos de Atención Primaria podría aportar una visión de conjunto derivada de su experiencia en el uso de los medicamentos en la práctica clínica real.
Determinadas técnicas y medicamentos de coste unitario elevado sí son evaluadas valorando los aspectos económicos al mismo nivel que los clínicos, incluso estableciendo umbrales de rentabilidad para el beneficio obtenido. Así el Grupo Génesis de la Sociedad Española de Farmacia Hospitalaria establece el valor de referencia de UCEI (umbral de coste efectividad incremental) por año de vida ajustado a calidad (AVAC) en 21.000 €/AVAC (11), y la Red de Agencias de Evaluación de Tecnologías Sanitarias (RedETS) en 25.000 €/AVAC (12,13). Sin embargo, terapias de coste unitario aparentemente reducido pueden generar costes e ineficiencias nada despreciables si se usan con una frecuencia elevada.
Desde un punto de vista ético, el uso de opciones terapéuticas innecesariamente caras con cargo a la sociedad (financiadora última del SNS) malinterpreta la beneficencia, puesto que una vez alcanzada esta, sobretratar y sobregastar no es beneficiente. Malinterpreta la autonomía, que va ligada a la propiedad de los recursos utilizados que, tanto si se realiza copago como si se disfruta de su bonificación, corresponde a la sociedad. Puede incurrir en maleficencia, por sobredosificación innecesaria. Y, sobre todo, es contraria a la justicia, puesto que detrae sin justificación recursos públicos que deberían haber beneficiado a otras personas.
Por lo tanto, antes de pagar cualquier novedad o innovación terapéutica, se debe analizar el impacto de la introducción de esta en la financiación por el SNS, incorporando el concepto de coste de oportunidad.
CONCLUSIONES
Este trabajo, realizado con una base de datos poblacional amplia y largo tiempo de estudio, revela, que el consumo de NE500/20 fue mayoritariamente puntual, y solo en una minoría de pacientes (7%) se mantuvo de manera prolongada en el tiempo. Existieron importantes diferencias en los patrones de prescripción entre los cupos médicos, concentrando el 22% de las consultas la mitad de los tratamientos prolongados. Se produjo un sobrecoste del 182% con el consumo de NE500/20 respecto a los equivalentes terapéuticos.
El comportamiento asociado a este medicamento fue en gran manera previsto por diversos servicios de farmacia, pero no por los organismos responsables de su autorización y financiación pública. Se debería estudiar la conveniencia de adecuar estos procesos a la realidad de la prescripción y de realizar un seguimiento post-comercialización no solo de los aspectos clínicos y farmacológicos, sino también de los económicos y sociales.
Los autores declaran que no existe ningún conflicto de intereses.
Sin financiación para la elaboración de este trabajo.
Bibliografía
- Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios. Boletín Oficial del Estado, 177, de 25 de julio de 2015, 62935 a 63030. Disponible en: https://www.boe.es/eli/es/rdlg/2015/07/24/1/con
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Vimovo. Última renovación el 09 de Marzo de 2018. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/73182/FT_73182.pdf
- Comité de evaluación de nuevos medicamentos de atención primaria de Euskadi, informe de evaluación Nº 198/2012 Disponible en: https://www.euskadi.eus/contenidos/informacion/medicamentos_atencion_primaria/es_def/adjuntos/N/naproxeno-esometrazol/naproxeno_esomeprazol_informe.pdfhttps://www.euskadi.eus/contenidos/informacion/medicamentos_atencion_primaria/es_def/adjuntos/N/naproxeno-esometrazol/naproxeno_esomeprazol_informe.pdf
- Ipswich and East Suffolk Clinical Commissioning Group. Suffolk PCT Drug & Therapeutics Committee New Medicine Report (Adopted by the CCG until review and further notice). Suffolk; 2011 Jun. Disponible en: https://ipswichandeastsuffolkccg.nhs.uk/Portals/1/Content/Members%20Area/Clinical%20Area/Medicine%20managment/Drugs%20and%20Therapeutics%20Advisory%20Group/New%20drug%20reports/Naproxen.pdf
- Lanas A, Benito P, Alonso J, Hernández-Cruz B, Barón Esquivías G, Pérez-Aisa A, et al. Recomendaciones para una prescripción segura de antiinflamatorios no esteroideos: documento de consenso elaborado por expertos nominados por 3 sociedades científicas (SER-SEC-AEG). Reumatol Clin. 2014; 10: 68-84. Disponible en: https://www.reumatologiaclinica.org/es-recomendaciones-una-prescripcion-segura-antiinflamatorios-articulo-S1699258X13002131
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Nexium. Última renovación el 23 de Mayo de 2011. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/63436/FT_63436.pdf
- Osakidetza. Inhibidores de la bomba de protones: Recomendaciones de uso. Infac. 2016; 24. Disponible en: https://www.osakidetza.euskadi.eus/contenidos/informacion/cevime_infac_2016/es_def/adjuntos/INFAC_24_n_8_%20IBP%20recomendaciones.pdf
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nota informativa de la reunión del Comité de Evaluación de Medicamentos de uso humano (CODEM) celebrada el 5 de abril de 2011. Disponible en: https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/comiteEvaluacion/2011/docs/codem_abril-2011.pdf?x42633
- Public Assessment Report of the Medicines Evaluation Board in the Netherlands. Vimovo 500 mg/20 mg, modified-release tablets AstraZeneca B.V., the Netherlands. 2011. Disponible en: https://db.cbg-meb.nl/Pars/h106235.pdf
- Directiva 2001/83/CE del Parlamento Europeo y del Consejo, de 6 de noviembre de 2001, por la que se establece un código comunitario sobre medicamentos para uso humano. Diario Oficial de las Comunidades Europeas, 311, de 28 de noviembre de 2001, 67 a 128. Disponible en: https://www.boe.es/buscar/doc.php?id=DOUE-L-2001-82523
- Ortega-Eslava A, Marín-Gil R, Fraga-Fuentes MD, López-Briz E, Puigventós-Latorre F. Guía de evaluación económica e impacto presupuestario en los informes de evaluación de medicamentos. Sociedad Española de Farmacia Hospitalaria. Noviembre del 2016. Disponible en: 961840-GUIA_EE_IP_GENESIS-SEFH_19_01_2017. Impacto económico.pdf (saludcastillayleon.es)
- 12. Giménez E, García Pérez L, Márquez S, Gutiérrez MªA, Bayón JC, Espallargues M. Once años de evaluaciones económicas de productos sanitarios en la Red de Agencias de Evaluación. Calidad metodológica e impacto del coste-utilidad. Gac Sanit. 2020; 34: 326-333. Disponible en: https://www.sciencedirect.com/science/article/pii/S0213911119301803?via%3Dihub
- Sacristán JA, Oliva J, Campillo-Artero C, Puig-Junoy J, Pinto-Prades JL, Dilla T, et al. ¿Qué es una intervención sanitaria eficiente en España en 2020? Gac Sanit. 2020; 34: 189-193. Disponible en: https://www.sciencedirect.com/science/article/pii/S021391111930175X?via%3Dihub
