Farmacoterapia del cáncer de próstata resistente a la castración no metastásico, implicaciones para el manejo desde atención primaria
Vidal Lopez C1, Ríos Quito GL2, Salom Garrigues C3, Pellicer Sanahuja AI4
1Farmacia Hospitalaria, Complejo Hospitalario Llerena-Zafra, Zafra, Badajoz, España
2Medicina Familiar y Comunitaria, EAP Cabezuela del Valle. Plasencia, Cáceres, España
3Farmacia Hospitalaria. Hospital Universitari Joan XXIII, Tarragona, España
4Medicina Familiar y Comunitaria, Hospital Universitari Sant Joan de Reus, Reus, Tarragona, España
El tratamiento del cáncer de próstata en estadios no metastásicos ha experimentado una importante evolución en los últimos años, con la introducción de los medicamentos inhibidores del receptor andrógenico: apalutamida, darolutamida y enzalutamida.
Aportan un beneficio considerable en términos de supervivencia libre de metástasis (40,5 meses en el caso de apalutamida (3), 40,4 para darolutamida (4) y 36,6 meses en el caso de enzalutamida (5)).
No obstante, muestran un perfil de toxicidades amplio a nivel cardiovascular, metabólico y óseo que pueden añadirse o exacerbar problemas de salud previos, en pacientes habitualmente geriátricos. Presentan además numerosas interacciones medicamentosas lo que debe tenerse en cuenta en estos pacientes frecuentemente polimedicados.
Es necesario un manejo multidisciplinar y coordinado de estos pacientes que permita diagnósticos y tratamientos precoces de estas toxicidades, representando un claro ejemplo de la imprescindible continuidad asistencial, en la que la Atención Primaria posee un papel clave.
The treatment of prostate cancer in non-metastatic stages has undergone significant evolution in recent years, with the appearance of the so-called androgen receptor inhibitor drugs: apalutamide, darolutamide and enzalutamide.
They provide considerable benefit in terms of metastasis-free survival (40.5 months in the case of apalutamide (3), 40.4 for darolutamide (4) and 36.6 months in the case of enzalutamide (5)).
However, they show a wide profile of toxicities at the cardiovascular, metabolic and bone levels which can add to or exacerbate previous health problems, usually in geriatric patients. They also present numerous drug interactions, which must be taken into account in frequently polymedicated patients.
A multidisciplinary and coordinated management of these patients is necessary to allow for early diagnosis and treatment of such toxicities, representing a clear example of the essential continuity of care in which Primary Care has a key role
INTRODUCCIÓN
En España, los tipos de cáncer responsables de una mayor mortalidad (1) son el cáncer de pulmón (22.930; 20,3%), seguido del colorrectal (16.470; 14,6%), páncreas (7.568; 6,7%), mama (6.606; 5,8%) y próstata (5.798; 5,1%).
El cáncer de próstata (CP) actualmente es el más frecuente en varones en nuestro país, con un total de 34.613 casos detectados durante el 2020 y una prevalencia de 259.788 casos (1).
El tratamiento antineoplásico del CP ha experimentado una importante evolución en los últimos años, especialmente en estadios no metastásicos.
El CP localizado tiene tratamiento curativo, que incluye prostatectomía radical y radioterapia, así como terapia de deprivación androgénica (ADT) con hormonoterapia, con análogos agonistas de la hormona liberadora de hormona luteinizante (LHRH) (goserelina, leuprorelina o triptorelina), antagonistas de LHRH (degarelix) o bloqueo androgénico completo (agonista de LHRH asociado a un antiandrogénico de primera generación: bicalutamida o flutamida).
Definimos el cáncer de próstata resistente a la castración (CPRC) como progresión de la enfermedad con niveles de testosterona sérica de castración (< 50 ng/dl o 1,7 nmol/L) y uno de los criterios siguientes:
a) Progresión bioquímica: niveles aumentados de antígeno prostático específico (PSA) en tres mediciones, distanciadas al menos una semana entre sí, con 2 elevaciones superiores al 50% respecto al nadir y un PSA > 2 ng/mL, o
b) Progresión radiológica: aparición de nuevas lesiones. Dos o más lesiones óseas nuevas en gammagrafía ósea o una lesión de tejido blando según RECIST (Response Evaluation Criteria in Solid Tumors) (2).
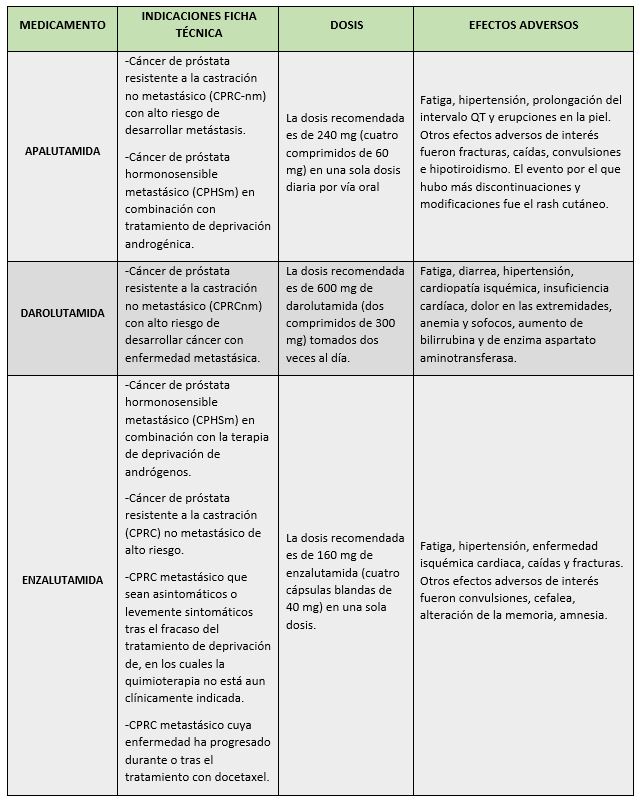
El tratamiento actual consiste en medicamentos inhibidores del receptor andrógenico (IRA): apalutamida, darolutamida y enzalutamida. Estos tratamientos han supuesto un cambio en el paradigma del manejo terapéutico del cáncer de próstata resistente a la castración no metastásico (CPRCnm), dado el beneficio que aportan en cuanto a supervivencia libre de metástasis (SLM: 40,5 meses en el caso de apalutamida (3), 40,4 para darolutamida (4) y 36,6 para el tratamiento con enzalutamida (5)).
Entre sus efectos adversos destacan: riesgo de convulsiones, hipertensión, cardiopatía isquémica, prolongación del intervalo QT, eventos cardiovasculares, exantema, caídas y fracturas.
La Dirección General de Cartera Común de Servicios del SNS y Farmacia establece como criterios de empleo de estos medicamentos en (CPRCnm) siguientes:
- alto riesgo de metástasis, tiempo de duplicación de PSA (PSDAT) < 6 meses,
- niveles de PSA ≥ 2 ng/ml, con niveles de testosterona bajo castración < 50 ng/dl o 1,7 nmol/l durante el tratamiento con agonista o antagonista LHRH o tras orquectomía bilateral,
- sin evidencia previa o presente de enfermedad metastásica, mediante el diagnóstico con las mejores pruebas de detección disponibles,
- valoración geriátrica de los pacientes potencialmente frágiles,
- análisis de las comorbilidades del paciente,
- consideración de la medicación concomitante.
Son tratamientos de reciente aprobación para esta indicación, y con medianas de duración de tratamientos de 40 meses, empleados en pacientes geriátricos y por tanto habitualmente polimedicados y que presentan además otras comorbilidades.
Considerando el mencionado perfil de los potenciales candidatos a estos tratamientos, es indispensable la detección y tratamiento de los EA asociados, así como la identificación de posibles interacciones medicamentosas.
Por todo ello es imprescindible un seguimiento multidisciplinar de estos pacientes, con una adecuada coordinación entre los diversos niveles sanitarios: médicos de familia, enfermeros, oncólogos, urólogos, farmacéuticos y otros profesionales que puedan contribuir a la prevención, detección y manejo de estas toxicidades y de las citadas interacciones medicamentosas.
Los profesionales de Atención Primaria tienen un papel fundamental en la coordinación del proceso asistencial y son en muchas ocasiones la primera referencia para el paciente en cuestiones de salud, tanto a nivel de consultas programadas o de urgencias.
Creemos necesario por ello que los facultativos de Atención Primaria se familiaricen con estas nuevas terapias y con las mencionadas toxicidades, lo cual es el objeto de esta publicación.
DESARROLLO DEL PROBLEMA
Los pacientes con cáncer de próstata no metastático (CPRC M0) con progresión bioquímica de la enfermedad y factores de mal pronóstico, se tratan habitualmente con terapia hormonal de deprivación androgénica (ADT), concretamente con castración quirúrgica (orquiectomía bilateral) o farmacológica con agonistas de LHRH. Habitualmente, la enfermedad progresa después de 12 a 48 meses de tratamiento con niveles de testosterona sérica < 50 ng/dl (CPRC).
Para los pacientes que desarrollan CRPC, la ADT con un agonista o antagonista de LHRH debe continuarse (6) para mantener los niveles séricos de castración de testosterona (<50 ng/dL), añadiéndose nuevos tratamientos como los que detallaremos a continuación.
Datos de eficacia
Hasta la aprobación de apalutamida, darolutamida y enzalutamida no se disponía de ningún fármaco aprobado para el tratamiento de pacientes con CPRC M0. La aprobación de apalutamida en esta indicación se basó en el ensayo de fase 3 SPARTAN (3) de 1207 pacientes con M0 CRPC y PSADT menor o igual a 10 meses. La edad media de los pacientes incluidos fue de 74 años. La mayoría eran caucásicos y presentaban un ECOG de 0.
Los pacientes tratados con apalutamida presentaron una supervivencia libre de metástasis superior a placebo, de forma estadísticamente significativa (apalutamida: 40,51 meses vs. placebo 15,70 meses; HR = 0,280 [IC 95% = 0,227-0,346]).
En el análisis final de supervivencia global del estudio SPARTAN, con una mediana de seguimiento de 52 meses, apalutamida mostró una mejora en la supervivencia global de forma
estadísticamente significativa en comparación con placebo (media apalutamida 73,9 meses vs. placebo 59,9 meses; HR = 0,78; p = 0,016) (7).
En cuanto a la darolutamida, el ensayo clínico fase III (estudio ARAMIS) (4), ciego doble, aleatorizado (2:1), multicéntrico, controlado con placebo que evalúa la eficacia y la seguridad de darolutamida en combinación con TPA frente a placebo con TPA en pacientes con CPRCnm. La variable principal del estudio fue la supervivencia libre de metástasis (SLM).
La media de edad de los pacientes fue de 74 años (48-95 años) y presentaban un promedio de tiempo de duplicación de PSA (PSADT) de 4,5 meses. Un 73% de los pacientes presentaban una puntuación de Gleason ≥ 7 en el momento del diagnóstico.
Los resultados de la variable principal demuestran beneficio para el brazo experimental con una mediana de SLM de 40,4 meses para darolutamida frente a 18,4 meses para placebo (HR=0,41; p<0,001).
En el análisis final del estudio ARAMIS (8), con una mediana de seguimiento de 29 meses, darolutamida mostró una mejora en la supervivencia global de forma estadísticamente significativa en comparación con placebo (mediana no alcanzada por ninguno de los dos brazos de tratamiento; HR = 0,685; IC 95% = 0,533-0,881; p = 0,003048).
En lo que se refiere a la enzalutamida, dispone de un ensayo pívot fase III, aleatorizado, multicéntrico, de ciego doble, controlado con placebo (estudio PROSPER) (5). La variable principal utilizada en este ensayo fue la supervivencia libre de metástasis (SLM). La mediana de edad de los pacientes incluidos fue de 74 años y la mayoría eran caucásicos y presentaban un ECOG de 0.
Se observó una mejora de la supervivencia libre de metástasis de forma estadísticamente significativa para los pacientes tratados con enzalutamida frente al grupo placebo (enzalutamida 36,6 meses vs. placebo 14,7 meses; HR = 0,292; IC 95% = 0,241-0,352).
En el análisis final de supervivencia global del estudio PROSPER (9), enzalutamida mostró una mejora en la supervivencia global de forma estadísticamente significativa en comparación con placebo (media enzalutamida 67 meses vs. placebo 56,3 meses; HR = 0,73; p = 0,001).
Datos de seguridad
Los efectos adversos más frecuentes de apalutamida (10) fueron fatiga, hipertensión, prolongación del intervalo QT y erupciones en la piel. Otros efectos adversos de interés fueron fracturas, caídas, convulsiones e hipotiroidismo. El evento por el que hubo más discontinuaciones y modificaciones fue el rash cutáneo.
En cuanto a darolutamida fueron adversos más reportados (11) con darolutamida fueron: fatiga, diarrea, hipertensión, cardiopatía isquémica, insuficiencia cardíaca, dolor en las extremidades, anemia y sofocos, aumento de bilirrubina y de enzima aspartato aminotransferasa.
En el caso de enzalutamida, se observaron los siguientes (12): fatiga, hipertensión, enfermedad isquémica cardiaca, caídas y fracturas. Otros efectos adversos de interés fueron convulsiones, cefalea, alteración de la memoria, amnesia. El evento por el que hubo más discontinuaciones y modificaciones de dosis fue la fatiga.
Osteoporosis y fracturas óseas
La pérdida de densidad mineral ósea se puede detectar después de seis a nueve meses de ADT, y una terapia más prolongada confiere un mayor riesgo.
Las fracturas esqueléticas osteoporóticas ocurren en hasta el 20 por ciento de los hombres dentro de los cinco años posteriores al inicio de la ADT.
La guía de la Sociedad Americana de Oncología Clínica (13) recomienda una ingesta dietética de calcio (alimentos y suplementos) de 1000 a 1200 mg diarios y suplementos de vitamina D de 800 a 1000 unidades internacionales diarias para todos los hombres que reciben ADT.
Igualmente, esta guía establece que para pacientes con cáncer no metastásico a quienes se les receta un medicamento que causa pérdida ósea o, cuya densitometría (DMO) basal o subsiguiente esté cerca del umbral de tratamiento con el cuestionario FRAX, se le debe ofrecer una prueba de DMO cada 2 años, o con mayor frecuencia si se considera médicamente necesario, según los resultados de las pruebas de DMO.
Se debe prescribir a los pacientes una combinación de diferentes ejercicios (13), incluyendo el entrenamiento de equilibrio, ejercicios de flexibilidad o estiramiento, ejercicio de resistencia y/o ejercicios progresivos de fortalecimiento, para reducir el riesgo de fracturas causadas por caídas.
En pacientes con cáncer no metastásico con osteoporosis (puntajes T de -2.5 o menos en el cuello femoral, cadera total o columna lumbar) o que tienen un mayor riesgo de fracturas osteoporóticas (probabilidad a 10 años de > 20 % para fracturas osteoporóticas mayores o > 3 % para fracturas de cadera) de acuerdo a la herramienta FRAX).; se debería emplear bisfosfonatos o denosumab subcutáneo a la dosis indicada para la osteoporosis, para reducir el riesgo de fractura.
Es muy importante resaltar que en estos pacientes el riesgo de fractura está aumentado dado que la ADT se emplea en concomitancia con los inhibidores del receptor androgénico (IRA).
Toxicidad cardiovascular
La terapia ADT se asocia frecuentemente a aumentos de concentraciones en sangre de colesterol total y de (LDL-C), y se ha asociado con un riesgo significativamente mayor de diabetes mellitus, síndrome metabólico y enfermedad de la coronaria (infarto de miocardio y muerte súbita) (14).
Los pacientes que comienzan con ADT, especialmente aquellos con alto riesgo, deben ser seguidos y manejados por un equipo multidisciplinar (14) para un óptimo control de los factores de riesgo: lípidos, glucemia y cifras tensionales.
Un metaanálisis demostró un 75 % más de riesgo de síndrome metabólico y un 36 % más de riesgo de diabetes en pacientes con ADT en comparación con los controles (15).
Datos recientes de una serie de casos de 100 pacientes candidato a ADT demostraron que el 39 % de los pacientes tenía una patología cardiovascular previa (arritmia, pericarditis, vasoespasmo coronario, etc.), que el 25 % tenía cardiopatía y el 50% tenía riesgo cardiovascular elevado, determinado según la puntuación de riesgo de Framingham (16).
Al igual que en los efectos sobre el metabolismo óseo, estos son sumativos a los de los inhibidores del receptor androgénico (10,11,12).
La terapia ADT se asocia además a prolongación del intervalo QT, aumentando por ello el riesgo de arritmias (17). Este efecto adverso está descrito también para los inhibidores del receptor androgénico.
Por ello antes de iniciar el tratamiento en los pacientes con antecedentes o factores de riesgo de prolongación del intervalo QT, y en los pacientes tratados de forma concomitante con medicamentos que pueden prolongarlo, se deberá evaluar dicho riesgo (17).
Uno de los aspectos importantes en el manejo de estos pacientes es realizar una valoración geriátrica inicial (18). Para ello se pueden emplear cuestionarios como el denominado cuestionario G8, que considera cuestiones como la edad, los cambios en la ingesta, IMC, la presencia de demencia o depresión, la toma de más de tres medicamentos y la autovaloración de su estado de salud comparado a otras personas de su misma edad.
Con este cuestionario se puede realizar un cribado de los pacientes candidatos a una valoración geriátrica integral. Se considera que un paciente es candidato a dicha valoración si el score obtenido en el cuestionario G8 es ≤ 14 puntos.
En relación a esto es además imprescindible evaluar en la consulta la calidad de vida disponiendo para ello de cuestionarios específicos como el FACT-P: Functional Assessment of Cancer Therapy-Prostate, que considera cuestiones como el bienestar físico, sociofamiliar, funcional y emocional.
INTERACCIONES MEDICAMENTOSAS
Los IRA son medicamentos implicados en numerosas interacciones farmacológicas y que además se emplean en un perfil de pacientes habitualmente geriátricos y por ello frecuentemente polimedicados.
Apalutamida interacciona con fármacos inhibidores de CYP2C8 (gemfibrozilo, clopidogrel) e inhibidores de CYP3A4 (ketoconazol, ritonavir, claritromicina).
No se recomienda el uso de inductores potentes y moderados del CYP3A4 ni de inductores de la P-gp (por ejemplo, carbamazepina, fenobarbital, hierba de San Juan, fenitoína y rifampicina) durante el tratamiento con darolutamida, excepto cuando no haya ninguna alternativa terapéutica. Enzalutamida por su parte interacciona con inhibidores de CYP2C8. A su vez apalutamida y enzalutamida son potentes inductores enzimáticos (19).
Apalutamida induce los siguientes citocromos o transportadores: CYP3A4, CYP2C19, OATP1B1, CYP2C9 (débil), UGT, P-gp, BCRP.
Darolutamida es un inductor débil del CYP3A4.
Por su parte enzalutamida es inductor de: CYP3A4 CYP2C9, CYP2C19, CYP2D6, CYP1A2.
Entre los medicamentos que con más frecuencia interaccionan tenemos: (10,11 y 12) Estatinas, anticoagulantes orales de acción directa acenocumarol, antagonistas del calcio, inhibidores de la bomba de protones, losartan, furosemida, clopidogrel, opioides y citalopram, entre otros.
CONCLUSIONES
La aprobación de los IRA ha supuesto un gran avance en el manejo de los pacientes con CPRCM0 con medianas de tiempo a la progresión a enfermedad metastásica próximas a los 40 meses.
El perfil habitual del paciente candidato a recibir estos tratamientos, al igual que en los estudios pivotales descritos (3,4,5) (mediana 74 años), es un paciente geriátrico y que por ello habitualmente padece otras comorbilidades.
Por todo ello es necesario un manejo integral de los mismos, sin obviar las recomendaciones propias del paciente geriátrico.
La consideración de las comorbilidades es de vital importancia a la hora de evaluar las posibles interacciones medicamentosas entre el tratamiento del cáncer de próstata y la medicación concomitante.
Los efectos adversos mencionados de los IRA (cardiovasculares, metabólicos, óseos) pueden verse agravados en pacientes con determinadas patologías previas.
Por otra parte, estas comorbilidades deben tenerse en cuenta a la hora de elegir el IRA más idóneo para nuestros pacientes de acuerdo a su perfil de toxicidad (18).
Uno de los aspectos importantes en el manejo de estos pacientes es realizar una valoración geriátrica inicial, mediante cuestionarios que permitan realizar un cribado de los pacientes candidatos a una valoración geriátrica integral.
En relación a esto es además imprescindible evaluar en la consulta la calidad de vida de estos pacientes disponiendo para ello de cuestionarios específicos como el FACT-P (18): Functional Assessment of Cancer Therapy-Prostate, que considera cuestiones como el bienestar físico, sociofamiliar, funcional y , emocional.
El manejo de estas toxicidades requiere un abordaje basado en la coordinación de los diversos servicios y ámbitos asistenciales implicados en la asistencia a estos pacientes, dada su potencial complejidad.
Todo ello mientras no se disponga de una adecuada integración en una aplicación informática única de todos los procesos asistenciales, de modo que todas las anotaciones y prescripciones estén unificadas mediante una plataforma informática que permita una visión global de dichos registros.
En esta continuidad, los profesionales de Atención Primaria tienen un papel central en la coordinación del proceso asistencial y por ser en muchas ocasiones la primera referencia para el paciente en cuestiones de salud a nivel de consultas de Medicina de Familia o Urgencias.
Estos profesionales deben formar un equipo multidisciplinar junto con los distintos profesionales de oncología, urología, farmacia y otros servicios que puedan contribuir a la prevención, detección y manejo de estas toxicidades.
Abreviaturas
- Tiempo de duplicación de PSA (PSADT)
- Terapia de deprivación androgénica (ADT)
- Cáncer de próstata resistente a la castración no metastásico (CPRCnm)
- Supervivencia libre de metástasis (SLM),
- Inhibidores del receptor andrógenico (IRA)
- Eastern Corporative Oncology Grouo (ECOG)
- Densitometría Mineral Ósea (DMO)
- Algoritmo de Evaluación de riesgo de fracturas óseas (FRAX®)
Consideraciones éticas, financiación y conflicto de intereses: ninguna.
Bibliografía
- Sociedad Española de Oncología médica. Las cifras del cáncer en España 2021. [internet] [Consultado 03/06/2021]. Disponible en: https://seom.org/images/Cifras_del_cancer_en_Espnaha_2021
- Cassinello J, Arranz JÁ, Piulats JM, Sánchez A, Pérez-Valderrama B, Mellado B, et al. SEOM clinical guidelines for the treatment of metastatic prostate cancer (2017). Clin Transl Oncol. 2018;20(1):57-68.
- Smith MR, Saad F, Chowdhury S, et al. Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med 2018; 378:1408- 1418. Available in: https://www.ncbi.nlm.nih.gov/pubmed/29420164
- Fizazi K, Shore N, Tammela TL, Ulys A, Vjaters E, Polyakov S, et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med. 2019; 380:1235-1246.
- Hussain M, Fizazi K, Saad F, Rathenborg P,Shore N,Ferreira U.et al.Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. N Engl J Med. 2018; 378:2465-2474
- National Comprehensive Cancer Network (NCCN) [Página principal en internet]. United States: Prostate cancer. Version 4.2022. [actualizado en mayo de 2022; acceso junio 2022]. Disponible en: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf
- Small Ej, Saad F, Chowdhury S, Oudard S, Hadaschik B, Graff J, et al, Final survival results from SPARTAN, a phase III study of apalutamide (APA) versus placebo (PBO) in patients (pts) with nonmetastatic castration-resistant prostate cancer (nmCRPC). ASCO Virtual Meeting, 29-31 May 2020, Abstract 5516.
- Fizazi K, Shore N, Tammela T, Ulys A, Vjaters E, Polyakov S, et al. Overall survival (OS) results of phase III ARAMIS study of darolutamide (DARO) added to androgen deprivation therapy (ADT) for nonmetastatic castration-resistant prostate cancer (nmCRPC). ASCO Virtual Meeting, 29-31 May 2020, Abstract 5514.
- Sternberg C, Fizazi K, Saad F, Shore N, De Giorgi U, PensonD et al.Final overall survival (OS) from PROSPER: A phase III, randomized, double-blind, placebo (PBO)-controlled study of enzalutamide (ENZA) in men with nonmetastatic castration-resistant prostate cancer (nmCRPC).ASCO Virtual Meeting, 29-31 May 2020, Abstract 5515.
- Ficha técnica de Erleada® (apalutamida). Disponible en: https://www.ema.europa.eu/en/documents/productinformation/erleada-epar-product-information_es.pdf. [Acceso Junio2022].
- Ficha técnica de Nubeqa ® (darolutamida). Disponible en: https://www.ema.europa.eu/en/documents/productinformation/xtandi-epar-product-information_es.pdf. [Acceso Junio2022].
- Ficha técnica Xtandi ® (enzalutamida). Disponible en: https://www.ema.europa.eu/en/documents/productinformation/xtandi-epar-product-information_es.pdf. [Acceso Junio2022].
- Shapiro CL, Van Poznak C, Lacchetti C, Kirshner J, Eastell R, Gagel R, et al. Management of Osteoporosis in Survivors of Adult Cancers with Nonmetastatic Disease: ASCO Clinical Practice Guideline. J Clin Oncol. 2019; 37(31):2916–46.
- Kenk M, Grégoire JC, Coté MA, Connely K, Davis M, Dressers G, et al. Optimizing screening and management of cardiovascular health in prostate cancer: A review. Can Urol Assoc J. 2020; 14: E458–E464.
- Bosco C, Crawley D, Adolfsson J, Rudman S, Van Hemelrijck M. Quantifying the evidence for the risk of metabolic syndrome and its components following androgen deprivation therapy for prostate cancer: A meta-analysis. PLoS ONE. 2015; 10: e0117344.
- Davis MK, Rajala JL, Tyldesley S, Pickles T, Virani SA. The prevalence of cardiac risk factors in men with localized prostate cancer undergoing androgen deprivation therapy in British Columbia, Canada. J Oncol. 2015; 820403.
- Gagliano-Jucá T, Travison TG, Kantoff PW, Nguyen PL, Taplin ME, Kibel AS, et al. Androgen Deprivation Therapy Is Associated with Prolongation of QTc Interval in Men with Prostate Cancer. J Endocr Soc. 2018; 2:485–96.
- Alcaraz Asensio A, Alvarez Ossorio JL, Cozar Olmo JM, Chantada Abal V, Juarez Soto A, Linares Espinos E, et al. Non-metastatic castration-resistant prostate cancer: management recommendations. Actas Urol Esp (Engl Ed). 2022;46(4):193-213.
- López-Campos F, Conde-Moreno A, Barrado Los Arcos M, Gómez-Caamaño A, García-Gómez R, Hervás Morón A. Treatment Landscape of Nonmetastatic Castration-Resistant Prostate Cancer: A Window of Opportunity. J. Pers. Med. 2021; 11: 1190.
Tabla resumen tratamientos orales de cáncer de próstata
Vidal Lopez C, Ríos Quito GL, Salom Garrigues C, Pellicer Sanahuja AI. Farmacoterapia del cáncer de próstata resistente a la castración no metastásico, implicaciones para el manejo desde atención primaria. Med fam Andal. 2022; 2: 133-142.
